わかりやすい医学教室
慢性骨髄性白血病 - 内服で完治可能になった不治の病 –
2025.07 らいふNo.106
血液内科 黒田 裕行
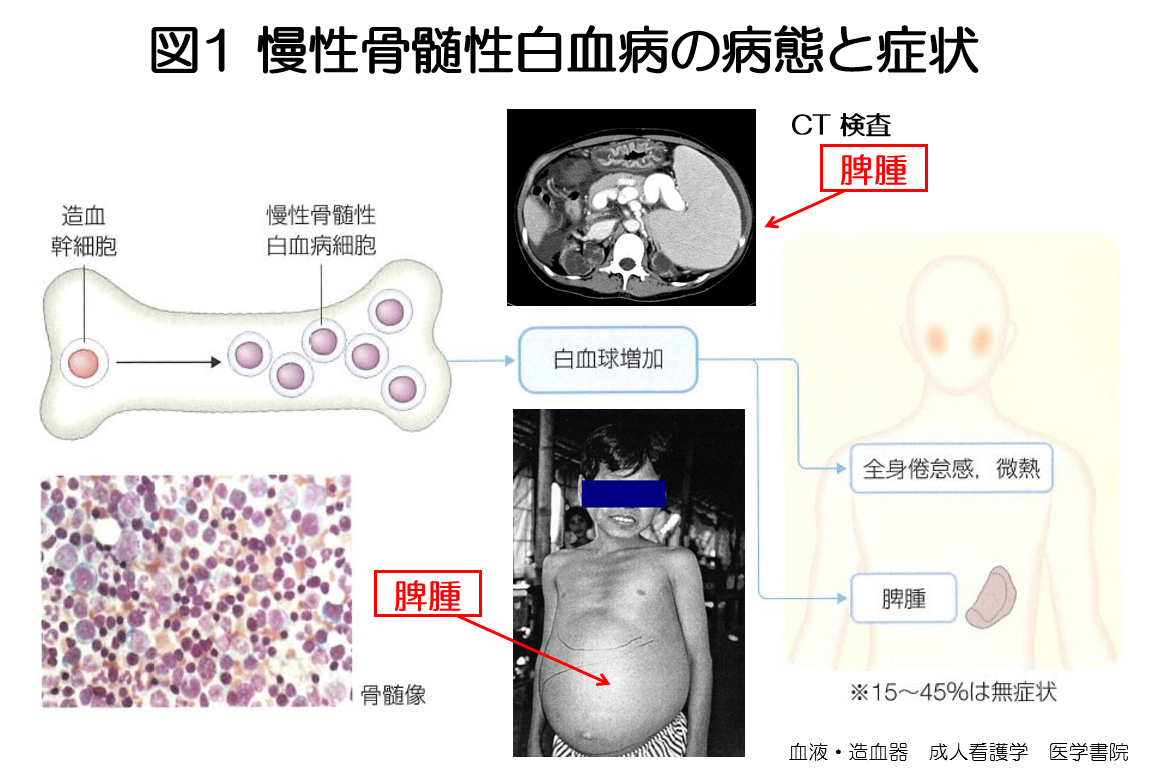
急性白血病と比較すると,「慢性骨髄性白血病」は聞きなれない病気かと思います。骨の中に血液をつくる骨髄という臓器があります。骨髄には白血球・赤血球・血小板に分化しうる造血幹細胞があり,白血病は造血幹細胞の「がん化」により発症します。白血病は「急性」または「慢性」,「骨髄性」または「リンパ性」に分類され,不治の病とされていた白血病の中でミレニアム(21世紀)以降飛躍的に治療成績が向上したのが「慢性骨髄性白血病」です。慢性骨髄性白血病は造血幹細胞が腫瘍化して,慢性的に白血球数が増加する病気です(図1)。白血球の数は,正常な時は血液 1μL(1Lの10万分の1)あたり4000~8000個ですが,慢性骨髄性白血病になると数万~十数万にも増えてしまいます。症状は現れにくく,健康診断や他の病気の検査で,偶然発見されることがほとんどです。ただし検査をする機会がない人では,白血球数が著明に増加すると,熱や痒みなどの症状や肝臓と脾臓の腫大をきたします(図1)。
疾病統計・発生要因・検査方法
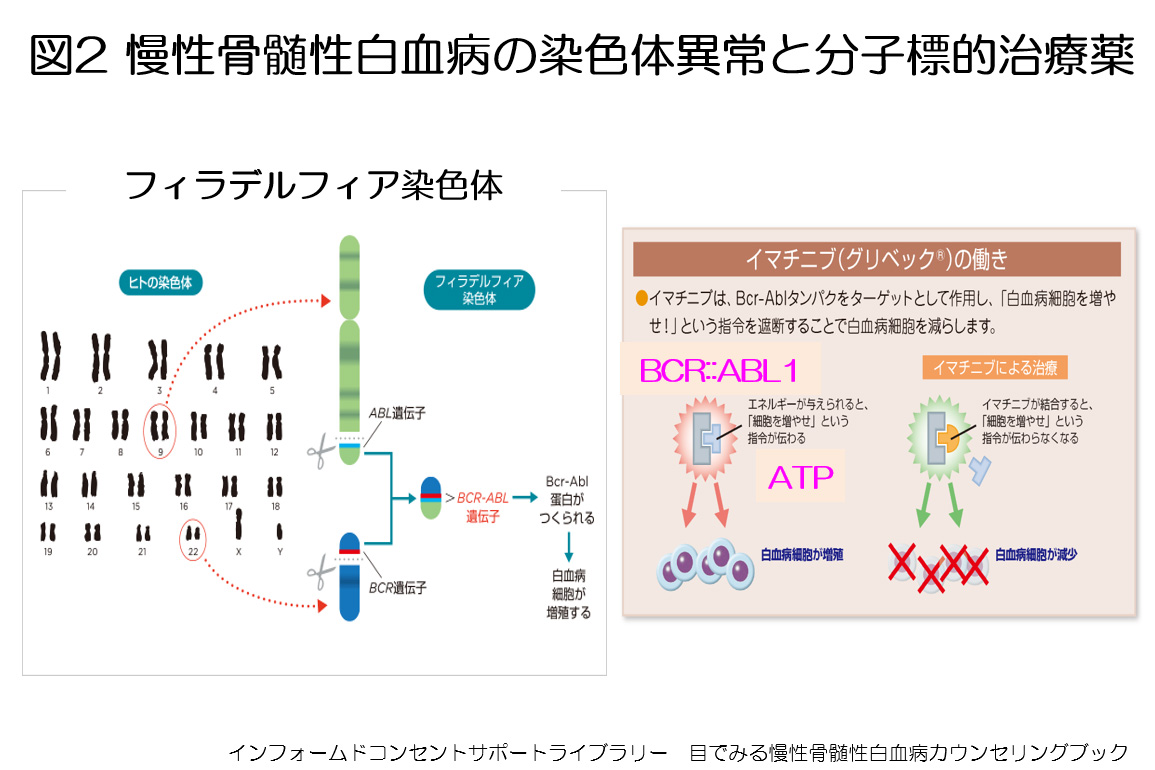
統計学的に発症年齢中央値は50歳くらいで,発病人数は年間10万人あたり1~2人です。発症要因として,9番と22番の染色体の相互転座(染色体の一部が切断され,お互いの染色体に融合すること)によるフィラデルフィア染色体が原因とされています(図2)。フィラデルフィア染色体においてBCR(ビーシーアール)::ABL1(エーブル)融合遺伝子が形成され,ATPという栄養(エネルギー)がABL蛋白に付着すると際限なく白血球が増加します(図2)。
内服の分子標的治療薬 従来のチロシンキナーゼ阻害薬とミリストイルポケット阻害薬 (図3)
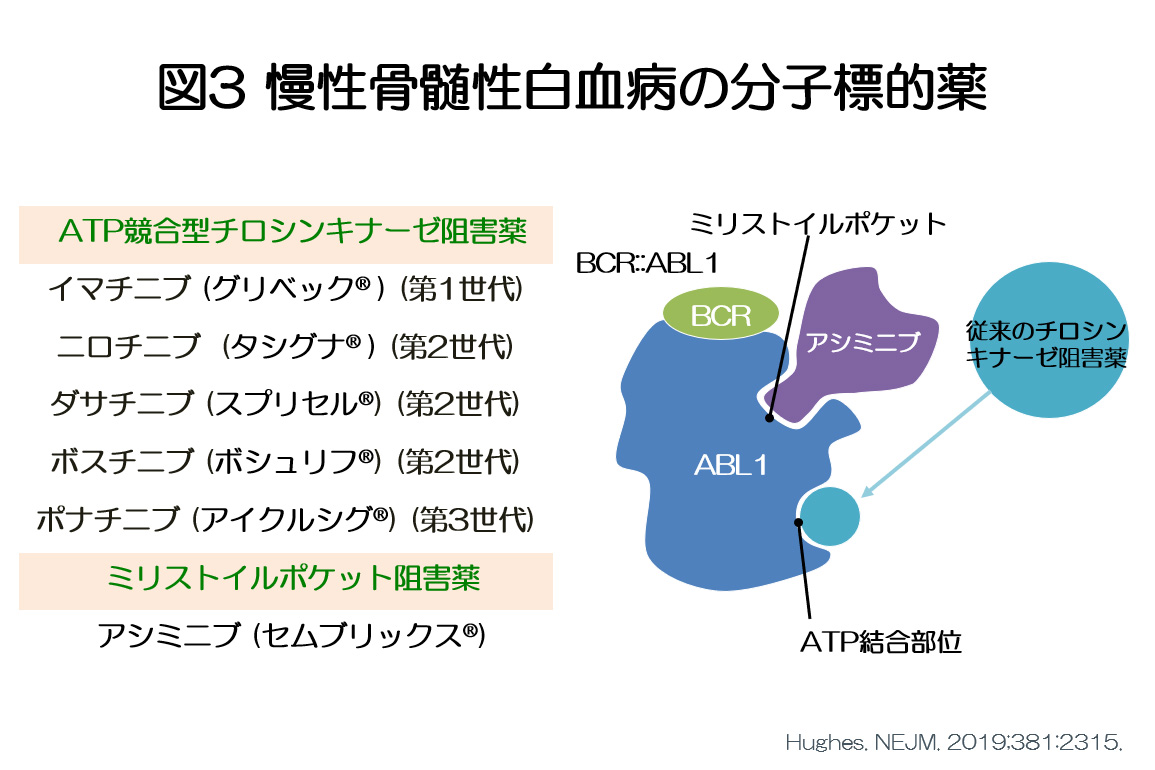
イマチニブ(商品名グリベック)は特異的にABLへ結合するような化学構造にデザイン化した分子標的治療薬(チロシンキナーゼ阻害薬)で,ABLへ栄養が結合するのをピンポイントで阻害することにより白血病細胞の増殖を抑えます(図2)。分子標的治療薬は腫瘍の原因となる遺伝子産物を狙い撃ちするため,従来の抗がん剤と比べて副作用が少ないのが特徴です。2001年からイマチニブが使われるようになり,それ以前は発病後10年の生存率が37%(10人中3~4人)であったのがイマチニブにより84%まで上昇しました。 近年チロシンキナーゼ阻害薬は改良され,2009年から第2世代のニロチニブ(商品名タシグナ)とダサチニブ(商品名スプリセル)が,2014年からボスチニブ(商品名ボシュリフ)が登場しました。まれですが,チロシンキナーゼ阻害薬の治療中にABL遺伝子ATP結合部位に遺伝子変異をきたすことがあり,その場合は分子標的治療薬が効かなくなります。それらの遺伝子変異を克服する第3世代のポナチニブ(商品名アイクルシグ)が2016年から販売され,二次治療として有効です。これまでのATP結合部位阻害薬と異なる機序で,ミリストイルポケット阻害薬であるアシミニブ(商品名セムブリックス)が2022年から登場しました。アシミニブはどの分子標的治療薬より効果があり,副作用が少ないためアシミニブを中止する患者さんの頻度が低いのが特徴です。2025年5月からアシミニブも未治療例への投薬が承認され,イマチニブ・ニロチニブ・ダサチニブ・ボスチニブ・アシミニブの5剤が初発の慢性骨髄性白血病で使用できるようになりました。
今後の慢性骨髄性白血病の治療
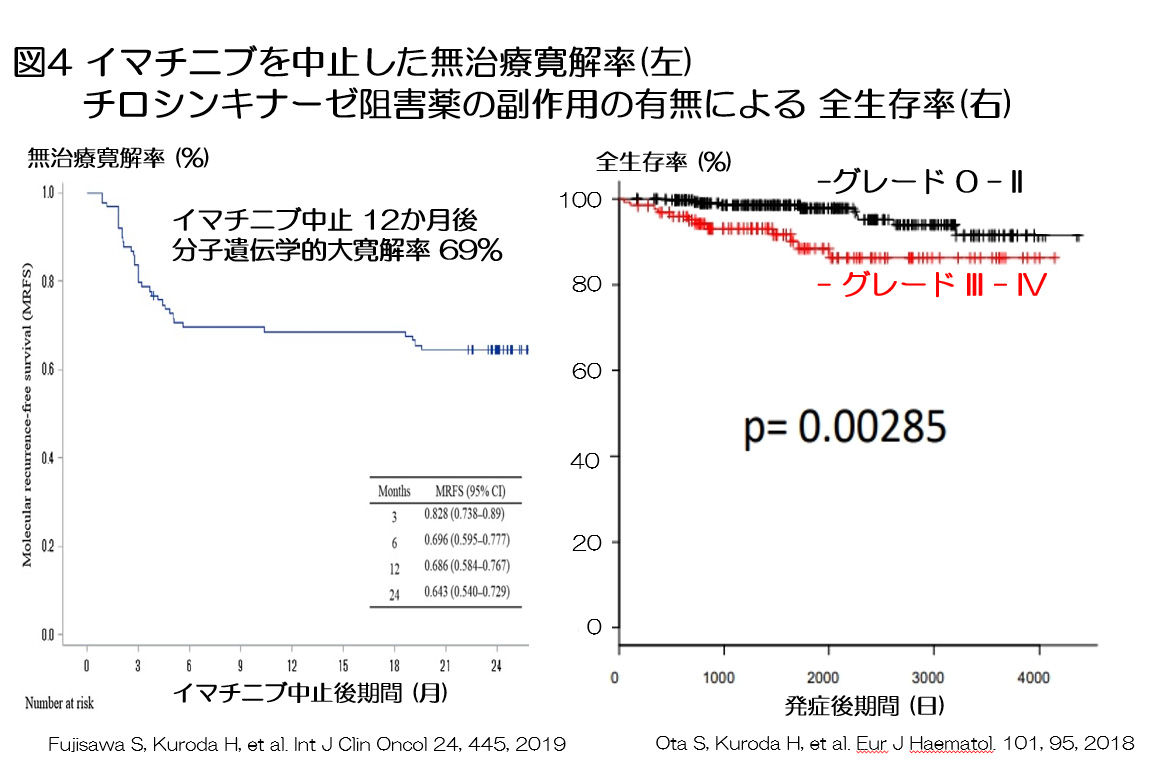
ミレニアムから分子標的治療薬により10年生存率は90%以上となり,現在では慢性骨髄性白血病自体で死亡する患者さんはほぼいません。私自身もイマチニブを長期内服した後に中止しても慢性骨髄性白血病を再発しない無治療寛解の患者さんが多数いることを実感しており,そのため参加した臨床研究で70%近くの方が分子標的治療薬の中止できることが判明しました(図4)。これまで分子標的治療薬の中止試験が多数報告され,深い分子遺伝学的寛解(PCRでのBCR::ABL1遺伝子陰性化)が長期間維持されていれば,一定の条件のもとで分子標的治療薬を中止できるようになりました。一方,私たちが参加した観察研究で,分子標的治療薬による副作用が重い,つまり高度の不耐容の方では長生きできないことも明らかになりました(図4)。今後はアシミニブにより副作用が軽減され完治する患者さんが増加すると考えます。当院でも不耐容の患者さんにアシミニブを内服いただき良好な経過が得られております。20世紀まで不治の病であった「慢性骨髄性白血病」も内服薬で完治が目指せるようになりました。今後は分子標的治療薬の副作用を引きずらないよう,また経済的負担を減らすようなど患者さんの生活の質の向上を目指した治療指針を見出すことが重要と考えます。